Últimas Noticias en Farma y Tecnología
Recibe diariamente las últimas novedades y cambios en el mundo de la contratación pública, la industria farmacéutica y la tecnología sanitaria.

NOTICIA DEL SECTOR SANITARIO
INFARMED aprueba tratamiento de Biogen para esclerosis múltiple recurrente-remitente
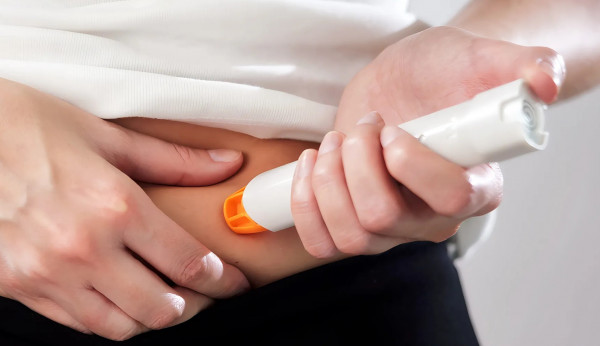
Plegridy (Peginterferon beta-1a) de Biogen, tratamiento para adultos con esclerosis múltiple recurrente-remitente (EMSR), a forma mais comum de esclerose múltipla (EM), fue aprobado por el INFARMED. Plegridy es administrado de dos en dos semanas con la Plegridy Pen, un nuevo auto inyector listo para usar.
20 Octubre 2015 | Fuente original

INFARMED aprova tratamento da Biogen para esclerose múltipla por surto-remissão
O Plegridy (Peginterferão beta-1a) da Biogen, tratamento para adultos com esclerose múltipla por surto-remissão (EMSR), a forma mais comum de esclerose múltipla (EM), foi aprovado pelo INFARMED. O Plegridy é administrado de duas em duas semanas com a Plegridy Pen, um novo auto-injetor pronto a usar.
O PLEGRIDY oferece às pessoas que vivem com EM um interferão com uma eficácia reforçada e com um perfil de segurança já bem estabelecido, que requer consideravelmente menos injeções do que outras terapêuticas injetáveis, afirma Sérgio Teixeira, Country Director da Biogen Idec Portugal, em comunicado.
Este é o segundo medicamento que a Biogen Idec disponibiliza no mercado neste ano e nesta área terapêutica, depois da aprovação de utilização do Tecfidera em maio, o que vem sedimentar a liderança e o compromisso que a Biogen tem vindo a demonstrar para com a comunidade de doentes com EM.
O PLEGRIDY é o único interferão peguilado aprovado para a utilização na EMSR e reduz vários parâmetros de atividade da doença, incluindo número de surtos, lesões cerebrais e progressão da incapacidade.
Esta aprovação baseia-se nos resultados de um estudo conduzido com interferão beta, o ADVANCE, que envolveu mais de 1.500 doentes com EMSR.
No ensaio clínico ADVANCE, o Plegridy administrado de duas em duas semanas reduziu significativamente a taxa anualizada de surtos (TAS) ao final de um ano em cerca de 36% quando comparado com placebo (p=0.0007).
O Plegridy reduziu o risco de progressão sustentada da incapacidade confirmada às 12 semanas em 38 por cento (p=0.0383) e às 24 semanas em 54 por cento (p=0.0069, análise post-hoc). Além disso o número de lesões captantes de gadolínio [Gd+] foi significativamente reduzido em 86 por cento (p<0.0001), quando comparado com placebo.
Os resultados de dois anos de ADVANCE confirmam que a sua eficácia robusta é mantida além do controlo com placebo no primeiro ano de estudo.
Noticias del Día
Habla con Nuestros Expertos
Descubre cómo podemos ayudarte a alcanzar tus objetivos
en el mercado sanitario.